糖尿病肾脏疾病(Diabetic Kidney disease,DKD),包括肾小球滤过率升高或下降、血液或/和尿液成分异常、特征性肾脏病理损伤及影像学检查异常等。是糖尿病常见且危害性大的慢性并发症之一。国外报道,有20~40%的糖尿病患者合并DKD,我国2型糖尿病患者的DKD患病率为21.8%[1]。在我国,DKD已逐渐成为引起终末期肾病(ESRD)的主要病因,由糖尿病导致的终末期肾病预后差,死亡率高[2]。而Juliana L.Meyers等人纳入121 395例T2DM合并中度至重度肾损伤患者的回顾性研究表明:早期诊断DKD可使患者进展为终末期肾病的危险性减少80%[3],因此早期筛查或诊断DKD,及早干预可减少ESRD的危害。目前,美国肾脏病基金会肾脏病预后质量倡议(KDOQI)和中国糖尿病肾脏病防治指南均提出,eGFR<60ml·min-1(1.73m2)-1和(或)尿白蛋白肌酐比值(UACR)>30mg/g为DKD临床诊断的主要标准,肾活检病理是DKD诊断的金标准[1,4]。但肾穿刺活检为有创检测,广泛开展受到限制。eGFR和尿白蛋白在DKD的诊断灵敏度和特异度方面存在不足[4-6]。现已有许多针对糖尿病肾脏疾病标志物的研究,包括蛋白质组学、代谢组学、基因组学、转录组学等,尿液已被公认为DKD蛋白标志物最合适的样本,不仅因为尿液在肾脏中产生,且还有许多优点:(1)采集简单,无创(2)稳定性好,可在-20℃保存很多年(3)尿标本制备前的分析方法简单[7]。目前已有许多研究表明,尿液蛋白类标志物在DKD的预测、早期诊断、预测疾病进展等方面发挥着重要作用。下述简述几种常见尿蛋白类标志物在DKD中的应用价值。
转铁蛋白相对分子质量为75000,生理状态下,受肾小球滤过膜负电荷同性排斥作用不容易滤过。病理状态下,肾小球滤过膜负电荷下降,转铁蛋白可从肾小球滤过膜滤过,难以被肾小管重吸收,出现在终尿中。相比白蛋白,u-TF所带负电荷更少,更易漏出,因而更能敏感地反映肾小球电荷屏障的受损。u-TF对于正常白蛋白尿的T2DM患者微量白蛋白尿的发生具有预测价值。近年更多研究证明u-TF在DKD早期表现更敏感[2]。
尿IgG相对分子质量为150000。生理状态下,分子量大,不易通过肾小球滤过膜。病理状态下,肾小球滤过膜受损或孔径变大时,IgG可滤出且不被肾小管重吸收,进入终尿。张岱等人纳入597例的2型糖尿病患者,研究24h尿转铁蛋白(TRF)、尿免疫球蛋白G(IgG)、尿视黄醇结合蛋白(RBP)、尿TH糖蛋白联合尿白蛋白检测对于糖尿病肾脏疾病的诊断意义,结果表明尿TRF、尿IgG以及尿RBP是DKD的独立危险因素[8]。
α1-MG是一种小分子糖蛋白,相对分子质量33000,生理状态下,经肾小球自由滤过, 95%~99% 在近曲小管被重吸收,并在肾小管上皮细胞溶酶体中降解。病理状态下,肾小管重吸收功能受损,可出现在终尿中,且受尿液pH变动影响较小。比白蛋白更早出现在糖尿病患者的尿液中,被认为是肾小管损伤的特异性标志蛋白。CHING-YE HONG等人纳入590例T2DM患者,检测尿α1-MG(以浓度对数值除以尿肌酐水平)情况,研究结果表明T2DM患者中尿α1-MG与疾病持续时间、严重程度以及疾病控制方式有关。尿α1-MG与白蛋白直接相关,但有些病人中两者可不同时升高,因此除检测肾小球功能异常的白蛋白外,代表肾小管功能损伤的尿α1-MG有助于糖尿病患者肾损伤的早期诊断[9]。
β2-MG,相对分子质量11800,生理状态下,β2-MG主要从肾脏排泄,95%循环β2-MG经肾小球自由滤过,99.8%经近端小管吸收及降解病理状态下,当近曲小管轻度受损时,尿β2-MG明显增加,是诊断近曲小管损害敏感而特异的指标。C Y Hong等人的研究表明,与无糖尿病大血管和/或微血管并发症的患者相比,糖尿病大血管和/或微血管并发症患者尿β2-MG较高,提示尿β2-MG与糖尿病血管并发症有关[10]。
RBP相对分子质量为21000。生理状态下,RBP经肾小球滤过后绝大部分被近端肾小管重吸收并被分解,供组织利用,仅少量从尿中排出。尿液中RBP浓度既与肾小球功能相关,又与肾小管重吸收功能相关,是反映近端肾小管重吸收功能的敏感指标[2]。Nicolas Pallet纳入162例肾活检CKD患者样本,研究各标志物与肾间质纤维化的相关性。单变量分析显示α1-MG、β2-MG以及RBP与间质纤维化(IF)均显著相关。与α1-MG、β2-MG相比,RBP预测IF的效果更佳。研究进一步分析了尿RBP诊断IF的有效性:RBP/肌酐>20mg/g预测>25%纤维化程度中特异性高达95%,但灵敏度20%(ROC曲线下面积0.7,P=0.0003)说明高浓度的尿RBP与肾间质纤维化有关[11]。
NGAL相对分子质量为25000。生理状态下,NGAL可经肾小球自由滤过,绝大部分在近曲肾小管被重吸收,尿中含量极微;尿液中NGAL升高主要源于肾小管受到损伤刺激后由肾小管上皮细胞大量产生并分泌入尿,含量可反映肾小管损伤程度。正常蛋白尿组中的DKD患者尿NGAL已明显高于正常对照组,能较好地反映肾小管损伤。如陈佳等人一项纳入167例2型糖尿病患者及50例非糖尿病患者的研究表明,尿NGAL与肾小球硬化、肾小管萎缩与间质纤维化(IFTA)、肾间质炎症、动脉透明变性程度正相关,与动脉硬化不具有相关性;尿NGAL能有效地评估肾小管间质损伤严重程度,曲线下面积最大(AUC=0.868),明显高于尿NAG、ACR、eGFR。尿NGAL的最佳截断值为177.6ng/gCr,评价DKD肾小管间质损伤的敏感度为71.9%,特异度为94.7%,表明尿NGAL是评价糖尿病肾病肾小管间质损伤理想的生物标志物[12]。
NAG相对分子质量为140000,存在于近曲小管上皮细胞溶酶体,通常血浆中的 NAG不能被肾小球滤过。尿NAG升高通常预示近端肾小管上皮细胞受损,溶酶体破裂释放NAG,尿NAG是反映肾小管损害的敏感且特异的指标[13]。Elizabeth F.O. Kerns基于一项糖尿病控制和并发症试验(DCCT)进行巢式病例对照研究,以1:2比例纳入87例微量蛋白尿T1DM患者及174例无微量蛋白尿的对照T1DM患者,再加4例微量蛋白尿患者与4例对照进行1:1匹配,最终为91例微量蛋白尿T1DM患者及178例无微量蛋白尿的对照T1DM患者;同时以1:2比例纳入55例大量蛋白尿T1DM患者及110例无大量蛋白尿的对照T1DM患者;测定DCCT实验中1-9年后出现微量蛋白尿或大量蛋白尿储存样本的尿NAG基线,判定尿NAG预测T1DM患者蛋白尿的预测能力;结果显示基线NAG排泄可独立预测微量蛋白尿(调整后OR=1.86,p<0.001)和大量蛋白尿(调整后OR=2.26,p<0.001),提示尿NAG是1型糖尿病患者蛋白尿的独立预测因子[14]。
糖尿病肾脏疾病病理生理机制复杂,至今尚未完全阐明,目前认为DKD的发生是代谢紊乱、血液动力学改变、炎症和纤维化等因素相互作用导致的结果。总之DKD会出现肾小球病变、肾小管病变、肾脏间质病变和肾血管病变等多方面的病理改变。因此,理论上来讲,多方面生物标志物质联合检测能更全方位反映DKD状况,代表不同部位损伤或者病理生理机制的尿液标志物可提示肾脏受损的部位、潜在的病因及病理生理过程。
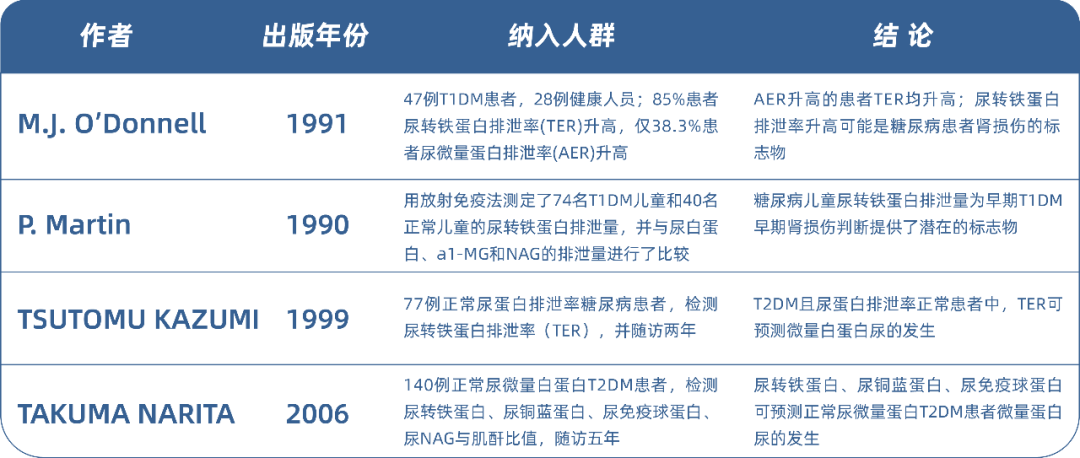
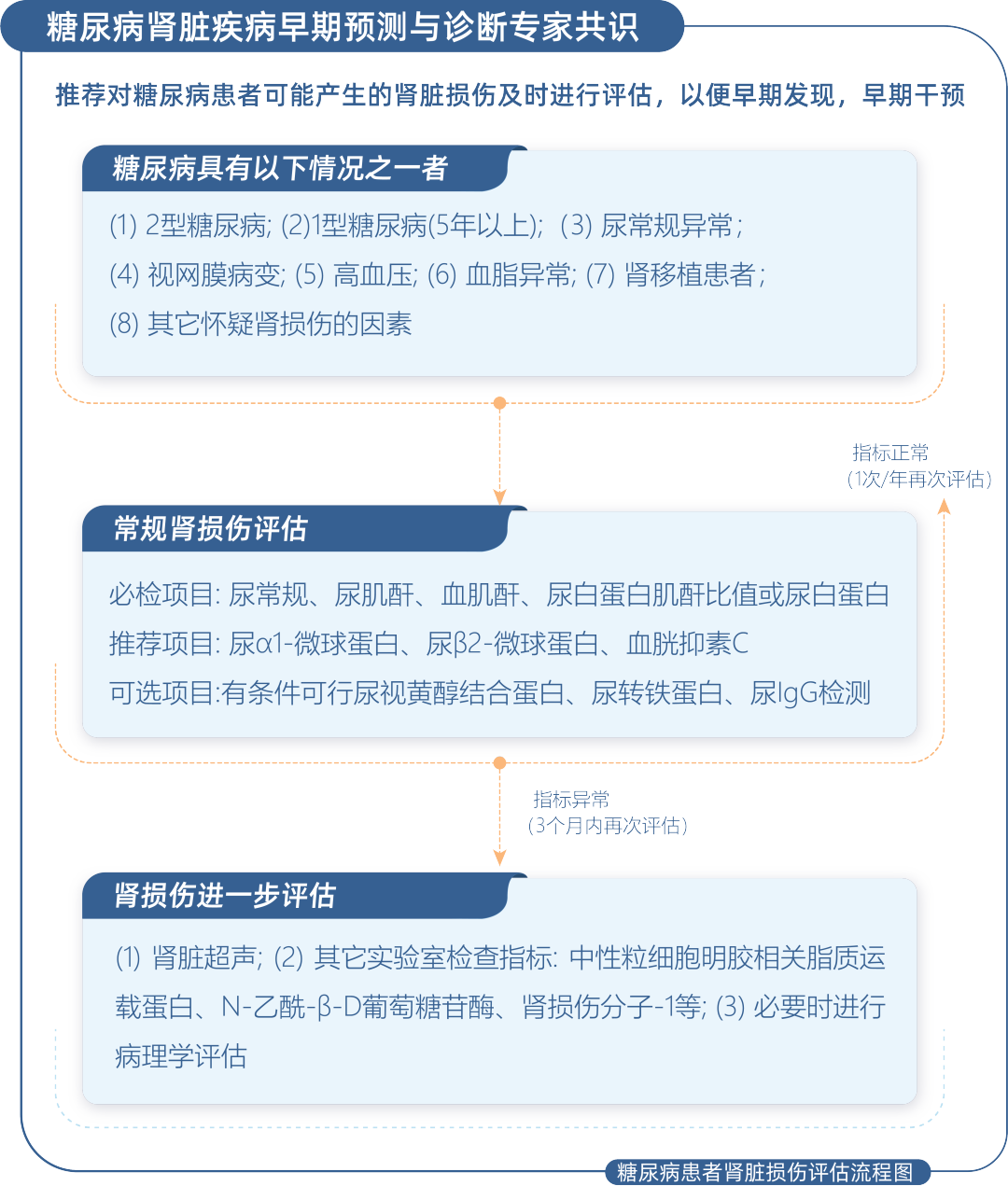
Deyuan Zhang等人纳入287例糖尿病患者和42例健康对照组。287例患者依据UACR分为正常蛋白尿组,微量蛋白尿组和大量蛋白尿组,评估9种尿液标志物和几种血清标志物在诊断糖尿病肾病中的作用,结果表明尿转铁蛋白(AUC=0.861)、尿IgG(AUC=0.894)、尿NGAL(AUC=0.875)以及尿TNF-α(AUC=0.763)无论是单独或者是联合在T2DM的早期诊断均具有潜在应用价值,但四项联合检测在早期糖尿病肾病的诊断价值更优良(AUC=0.922)[15]。糖尿病肾脏疾病早期预测与诊断专家共识组2021年发表在中华内科杂志上的《糖尿病肾脏疾病早期预测与诊断专家共识》明确描述了糖尿病患者肾脏损伤评估流程(如下图1),推荐进行UACR或尿白蛋白等必检项目的基础上,联合进行其他尿液标志物的检测。
图1:糖尿病患者肾脏损伤评估流程图
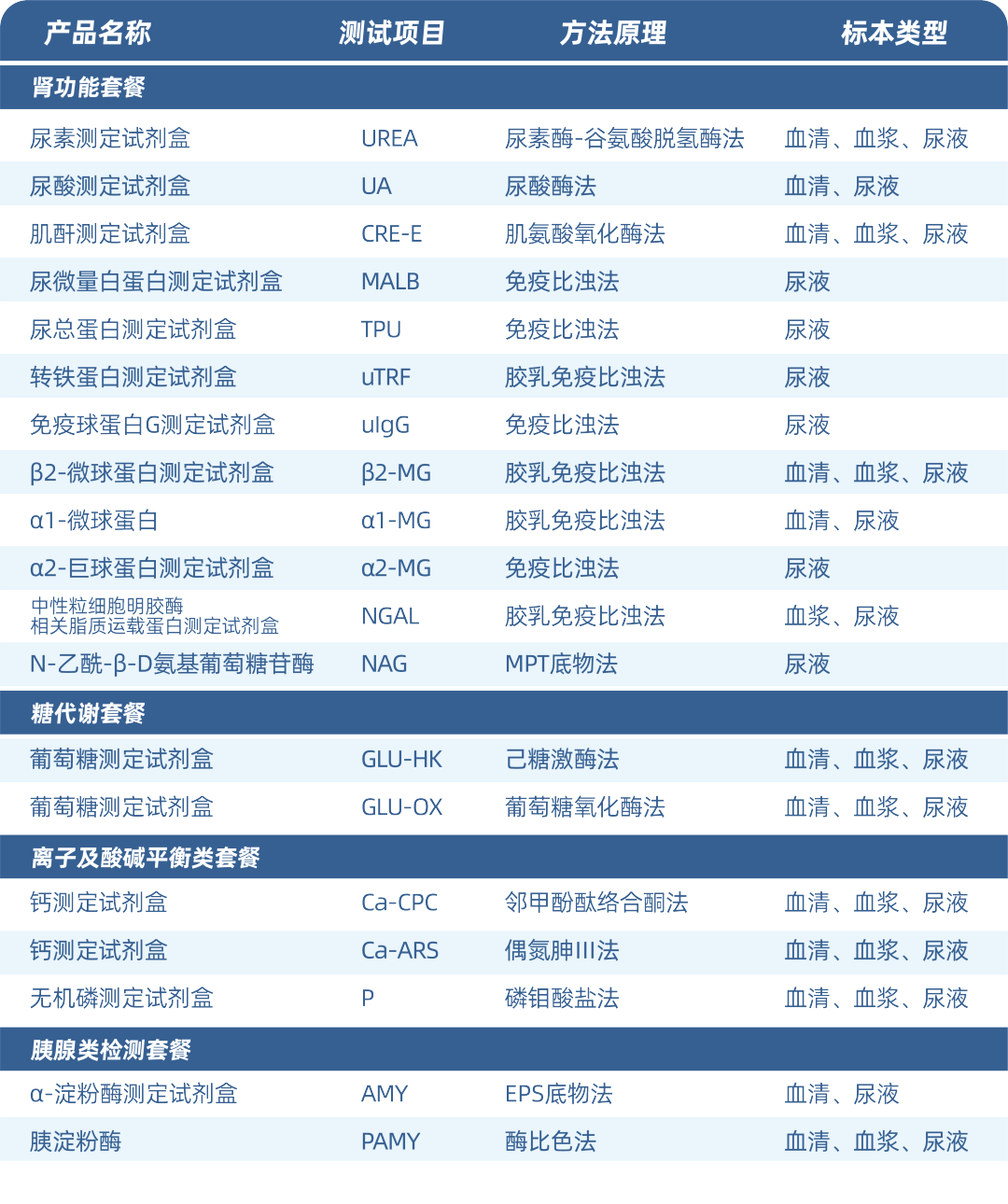
迪瑞拥有全面的尿生化检测项目,涵盖可反映肾小球通透性、滤过率;肾小管重吸收功能和结构损伤的标志物,可多方位评估肾功能损害。
迪瑞拥有全面、系列的生化分析仪器系统,CS系列生化分析仪器从180速到9600速均可检测尿生化项目,可满足不同客户需求。
迪瑞CS-680(CS-1200)全自动生化分析仪,生化比色测试速度可达600(800)T/H,选配ISE综合测速为1000(1200)T/H。